رنگآمیزی باکتری به عنوان یک فناوری مهم در زمینه میکروبیولوژی، ریشههایی قدیمی دارد. از زمان کشف مایکروسکوپ و شناسایی اولین باکتریها توسط لوئی پاستور، تلاشهای بسیاری برای توسعه روشها و رنگهای جدید در رنگآمیزی باکتری صورت گرفته است. اما در سالهای اخیر، با پیشرفت تکنولوژی و استفاده از روشهای نوین مانند رنگآمیزی فلورسنت، تشخیص باکتریها به صورت سریع، دقیق و حساس تر امکانپذیر شده است.
روشهای رنگ آمیزی
۱- رنگآمیزی ساده (Simple Staining)
در این نوع رنگآمیزی تنها از یک رنگ مانند میتلن بلو استفاده میشود. متیلن بلو رنگ آنیلینی است که بسیاری از باکتریها، این رنگ را بیشتر از سلولهای دیگر به خود جذب میکنند.
بطور مثال در رنگآمیزی مایع نخاع و یا ترشحات مجرای ادراری-تناسلی که تشخیص یک باکتری گرم منفی در زمینۀ قرمز مشکل است، از متیلن بلو برای رنگآمیزی استفاده میکنند. در این روش متیلن بلو را روی گسترش ریخته و پس از یک دقیقه لام (Slide) را با آب شستشو میدهیم. به این ترتیب کلیۀ باکتریها و سلولهای موجود در نمونه به رنگ آبی دیده میشوند.
۲- رنگآمیزی منفی (Negative staining)
در این روش از رنگهایی مانند نیگروزین یا مرکب چین استفاده میشود. روی لام قطرهای از کشت باکتری را با رنگ مخلوط و گسترش تهیه مینماییم. چون رنگ نمیتواند به داخل باکتری نفوذ نماید، باکتریها در زمینۀ سیاه، بیرنگ دیده میشوند.
۳- رنگآمیزی افتراقی (Differential staining)
در این روش از چند محلول رنگی استفاده میشود تا تفاوت موجود بین ترکیبات شیمیایی منجر به افتراق باکتریها از یکدیگر گردد. در میکروبشناسی پزشکی، بیشتر از رنگآمیزی گرم (Gram) و اسید فست (Acid fast) استفاده میشود.
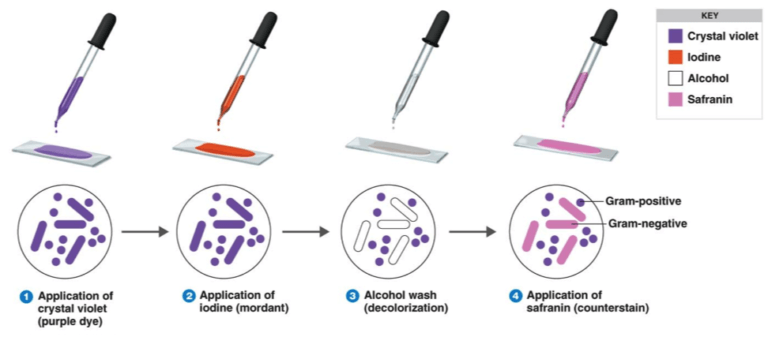
رنگآمیزی گرم (Gram Staining)
این تکنیک در سال ۱۸۸۴ توسط هانس کریستین گرم ابداع گردید. در این روش باکتریها بر اساس ساختمان شیمیایی دیوارۀ سلولی به دو رنگ قرمز و بنفش دیده میشوند. در این رنگآمیزی از ۴ محلول مختلف استفاده میشود:
رنگ اول کریستال ویوله Hexamethyle-p-rosanaline chloride است، که کلیۀ باکتریها را به رنگ بنفش درمیآورد. سپس محلول لوگل (Potassium-Iodide-Iodine solution) اضافه گشته و یُد جای کلر را در مولکول کریستال ویوله میگیرد. (عمل دندانهزدن به منظور تثبیت رنگ در دیواره سلولی میباشد). ترکیب حاصله در آب نامحلول بوده و باکتریهای گرم مثبت و گرم منفی واکنش یکسانی دارند. وقتی در مرحلۀ بعد بیرنگ کننده اضافه شود، رنگ تنها از باکتریهای گرم منفی خارج میگردد. اگرچه دلایل زیادی برای این مسأله آمده است از جمله تفاوت در میزان اتصال به منیزیم، ریبونوکلئازها، پلیآمینها، اسیدهای نوکلئیک و یا تفاوت در قدرت نفوذپذیری رنگ بخاطر اختلاف در ساختمان، ولی مشاهدات اخیر نشان میدهد که بیرنگ کننده به غشاء خارجی باکتریهای گرم منفی آسیب رسانده و باعث خروج کمپلکس کریستال ویوله-ید میگردد. سپس رنگ زمینه یعنی سافرانین اضافه میشود و باکتریهای گرم منفی به رنگ قرمز درمیآیند. باکتریهای گرم مثبت که دیوارۀ سلولی آنها به دلایلی آسیب دیدهاند (مانند سلولهای پیر و مرده) رنگ زمینه را گرفته و موجب اشتباه در تشخیص میگردد.

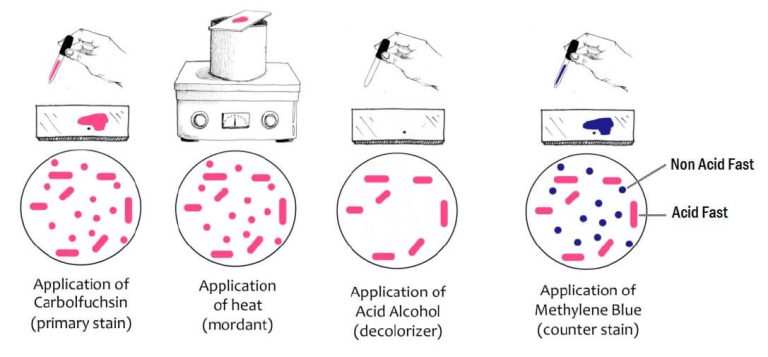
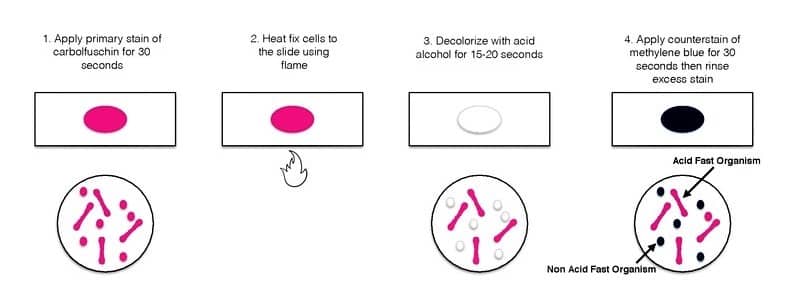
رنگآمیزی اسید فست (Acid fast staining)
برخی باکتریها مانند مایکوباکتریا، رنگ خود را پس از بیرنگ کردن با اسید یا اسید الکل، حفظ مینمایند. این خصوصیت به دلیل وجود مایکولیک اسید در دیوارۀ سلولی این باکتریهاست. به این منظور از حرارت، حلالهای آلی و یا دترجنتها برای تسهیل عمل رنگآمیزی استفاده میشود. رنگآمیزی اسیدفست به سه روش زیل نیلسون (Ziehl-Neelsen) کینیون (Kinyoun) و فلوروکروم (Flourochrome) انجام میگیرد.
رنگآمیزی اندوسپور (Endospore Stain):
برخی باکتریها در شرایط محیطی سخت، قادرند ساختارهای مقاومی به نام اندوسپور را تشکیل دهند تا از باکتریها در مقابل شرایط نامساعد، محافظت کند. باکتریها در شرایط مساعد مجدد به فرم رویشی تبدیل میشوند.
در این روش ابتدا اندوسپورها با مالاشیت گرین به همراه حرارت رنگآمیزی میشوند که این رنگ بسیار قوی است و میتواند به اندوسپورها نفوذ کند. پس از تیمار مالاشیت گرین، بقیه سلول که رنگ نگرفته است با آب شسته شده و با سافرانین رنگآمیزی میشود. در آخر باکتریها به رنگ قرمز و اندوسپورها به رنگ سبز در داخل سلول باکتری قابل مشاهده است.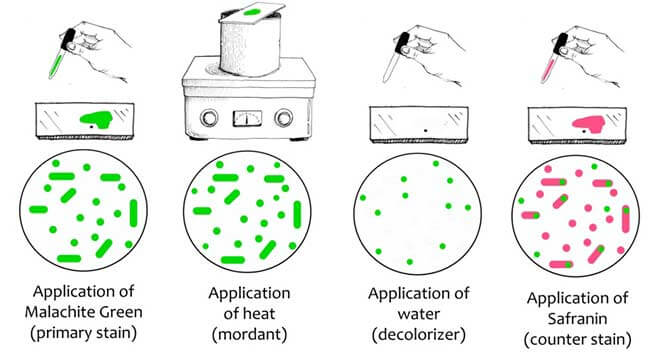
رنگآمیزی اختصاصی
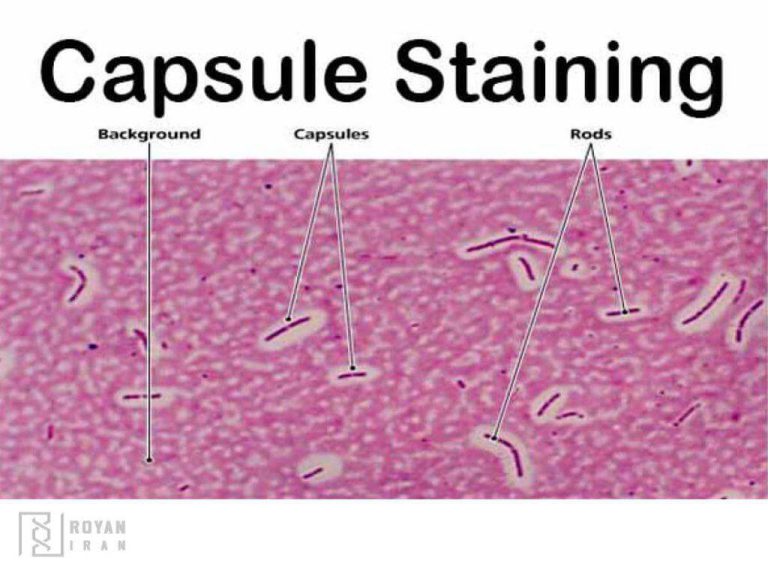
تفکیک انواعی از باکتریها، گاهی با رنگآمیزی اختصاصی و مشاهده اجزای خاصی از باکتری مانند اسپور، فلاژل، کپسول و… انجام میشود. مانند رنگآمیزی اسپور، فونتانا و آلبرت.


دیدگاه خود را بنویسید